Die Vogelgrippe wurde in kurzer Form bereits hier vorgestellt. Aber gerade in der kalten Jahreszeit liest man immer wieder von Vogelgrippeausbrüchen und deren Folgen für die Nutztierhaltung. Auch Zoss und Wildparks werde inzwischen jährlich damit konfrontiert ihren (teilweise seltenen) Vogelbestand vor dem Virus zu schützen. Auch wenn es Impfmöglichkeiten gibt, die auch in der EU zugelassen sind, werden diese, soweit mir bekannt ist, nicht überall eingesetzt. Viele Zoos und Wildparks scheinen davon Gebrauch zu machen, aber in der landwirtschaftlichen Nutztierhaltung verlässt man sich vorrangig auf Stallpflicht, Biosicherheitsmaßnahmen und Monitoring-
Vogelgrippe H5N1 ist eine Viruserkrankung der Vögel, hervorgerufen durch das Influenza-A-Virus H5N1 (A/H5N1). Wie alle anderen durch Influenza-Viren verursachten Geflügelkrankheiten ist auch die Vogelgrippe H5N1 bei in Gefangenschaft gehaltenen Vögeln und bei Wildvögeln in zahlreichen Ländern eine anzeigepflichtige Tierseuche, gegen die umgehend amtliche Maßnahmen zu ihrer Bekämpfung und zur Verhinderung ihrer Ausbreitung eingeleitet werden können. In Einzelfällen sind die Viren auf Menschen und andere Säugetiere übertragen worden, die Erkrankung ist folglich eine Zoonose. Der erste wissenschaftlich dokumentierte Ausbruch von A/H5N1 ereignete sich 1959 in Schottland.
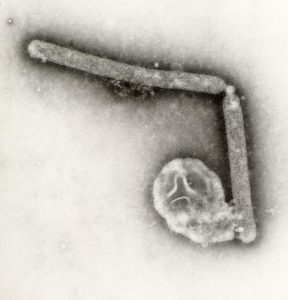
Das Virus Influenza A/H5N1 ist ein behülltes Einzel(−)-Strang-RNA-Virus aus der Familie der Orthomyxoviridae. Der Durchmesser des Virus beträgt etwa 100 Nanometer, es besitzt etwa 14.000 Nukleotide.
Der Erhalt der Infektionsfähigkeit des Erregers ist in der Außenwelt nicht sehr hoch und kann durch die Desinfektionsmittel mit deklarierter Wirksamkeit für das Wirkungsspektrum „begrenzt viruzid“ unschädlich gemacht werden. Jedoch kann das Virus – geschützt durch organisches Material wie Körpersekrete, Kot und Ähnliches – in Tierställen und insbesondere bei niedrigen Temperaturen einige Wochen überstehen. Infektiös bleiben die Viren bei 4 °C zum Beispiel ca. 30 bis 35 Tage in Kot, Geflügelfleisch oder gelagerten Eiern, bei 37 °C hingegen nur sechs Tage. Nach bisherigen Erkenntnissen sind die Viren nicht mehr infektiös, wenn sie Temperaturen über 70 °C ausgesetzt wurden, so dass eine Übertragung über durchgegarte Eier oder andere durchgegarte Geflügel- und Fleischprodukte als ausgeschlossen gilt.
Die Folgen der seit 1997 gehäuft auftretenden H5N1-Ausbrüche gelten laut New Scientist als die schlimmste Erkrankungswelle, die jemals unter Tieren bekannt geworden ist, vergleichbar allenfalls mit der Rinderpest. Grundsätzlich werden bei Zuchtgeflügel die gleichen Infektionswege wie bei anderen Influenzaviren beobachtet: Die H5N1-Viren können durch Kotpartikel verbreitet werden, die über sogenannte „Hühnerabfälle“ (Tierreste) auch in industrielles Geflügelfutter gelangen können; ferner können sie beim Schlachten über Blut sowie über Kleidung und Arbeitsgeräte verbreitet werden.
Auf einer gemeinsamen Konferenz der FAO und der Weltorganisation für Tiergesundheit (OIE) wurde Ende Mai 2006 jedoch von Forschern der Erasmus-Universität (Rotterdam) darauf hingewiesen, dass H5N1-Viren bei Wildvögeln – anders als sämtliche anderen bekannten Influenzaviren – offenbar stärker über den Atemtrakt als über den Kot ausgeschieden werden. Dies erkläre möglicherweise, warum unter nahezu 100.000 Kotproben von lebenden Wildvögeln, die in den 10 Monaten vor Mai 2006 in Europa analysiert wurden, kein einziger H5N1-Fall entdeckt wurde.
Umstritten ist, welcher Anteil dem Handel mit Vögeln sowie mit Geflügelprodukten bei der Ausbreitung von A/H5N1 zukommt und welcher Anteil den Wildvögeln. Die US-amerikanische Gesundheitsbehörde CDC erläutert in diesem Zusammenhang, dass weltweit einzelne Wildvögel das Virus in sich tragen, ohne daran zu erkranken; Aus Amerika wurden erstmals 2015 H5N1-Nachweise bekannt, in Australien scheint A/H5N1 bislang noch nicht angekommen zu sein.
2010 bestätigte eine Studie, dass sich mit Kleinstsendern ausgestattete Spießenten im Jahr 2008 auf ihren Flugrouten zwischen Japan und dem nordasiatischen Festland in Gewässern aufhielten, auf denen infizierte Singschwäne heimisch waren. Dies wurde als Unterstützung der Hypothese interpretiert, dass Wildvögel die Viren entlang ihrer Wanderrouten verbreiten können. Auf regionaler Ebene wurde 2020 für China berechnet, dass die Verbreitung von aviären Influenzaviren auch entlang der Handelswege von Geflügel erfolgt.
Das Friedrich-Loeffler-Institut veröffentlichte zuletzt im Juli 2022 eine aktualisierte Risikoeinschätzung für Deutschland. Das Risiko der Aus- und Weiterverbreitung der HPAI-H5-Viren in Wasservogelpopulationen im Zusammenhang mit der hohen Dichte in Brutkolonien oder eines zu erwartenden Wasservogelbesatzes an Mauser- und Sammelplätzen, vor allem aber an den Küstenregionen, wurde als hoch eingestuft. Das Risiko eines Eintrags in Geflügelhaltungen und Vogelbestände wurde in diesen Regionen als hoch, ansonsten als gering eingestuft.
Die Symptome des akuten Verlaufs einer H5N1-Infektion sind identisch mit den Symptomen, die andere Virussubtypen der Geflügelpest hervorrufen. Besonders schwer ist der Krankheitsverlauf regelmäßig bei Hausgeflügel, insbesondere bei Hühnern und Truthühnern. Als Inkubationszeit werden von der Weltorganisation für Tiergesundheit (OIE) „maximal 21 Tage“ ausgewiesen.
Neben Zeichen allgemeiner Schwäche (Apathie, Inappetenz, stumpfes, struppiges Federkleid) treten hohes Fieber, eine erschwerte Atmung mit geöffnetem Schnabel, Ödeme (d. h. Schwellungen aufgrund Flüssigkeitsaufstauung) an Kopf, Hals, Kamm, Kehllappen, Beinen und Füßen, Blauverfärbung von Haut und Schleimhäuten, wässerig-schleimiger und grünlicher Durchfall, neurologische Störungen (sonderbare Haltung des Kopfes, Störungen der Motorik) auf. Die Legeleistung sinkt, die Eier sind dünnwandig oder schalenlos. Die Mortalität in infizierten Hausgeflügelbeständen ist sehr hoch: Der Tod tritt bei nahezu allen Tieren ein.
Influenza A-Viren sind unter wildlebenden Enten und anderen Wasservögeln weit verbreitet; diese Tiere werden daher als „natürliches Reservoir für das Virus“ bezeichnet. Charakteristisch für solche Reservoirwirte ist häufig, dass sie selbst gar nicht oder zumindest nicht schwer erkranken. Evolutionsbiologen deuten derartige Formen einer Koexistenz dahingehend, dass sich auf längere Sicht vor allem jene Virus-Varianten in der Population ihrer Reservoirwirte verbreiten, die ihre Wirte nicht töten. Wird nämlich der Wirt – zumal sehr rasch – getötet, stirbt mit ihm auch die im Wirt ansässige Viren-Population ab; größere Vermehrungschancen haben daher jene Varianten eines Virustyps, die ihren Wirt langfristig zur Vermehrung und Verbreitung nutzen (attenuierte Viren). Aber auch sie können Vektoren sein, und ihr Wanderverhalten (Vogelzug) kann zur Verbreitung beitragen.
A/H5N1 fiel in Asien zunächst dadurch auf, dass durch dieses Virus auch viele von anderen Influenza A-Viren weniger stark gefährdete Zugvögel getötet wurden. Daraufhin wurden ab Anfang 2003 in Südchina und Hongkong tausende Kot- und andere Proben von Wildvögeln auf A/H5N1 untersucht, ohne dass zunächst Viren gefunden wurden. Erst Anfang 2005 wurden H5N1-Viren bei sechs offensichtlich gesunden Wildenten am Poyang-See in der chinesischen Provinz Jiangxi nachgewiesen. Die chinesischen Forscher hatten zugleich mehr als tausend serologische Proben von Wildenten untersucht und bei drei Prozent davon Antikörper gegen A/H5N1 entdeckt, was als Anzeichen einer früheren Infektion bewertet wurde. Die Forscher vermuteten, dass einzelne Zugvögel die Viren über große Strecken verbreiten können, dass gehäufte lokale Ausbrüche hingegen auf infiziertes Nutzgeflügel zurückzuführen seien. Vergleichbare Ergebnisse wurden 2007 aus Europa bekannt: Forscher aus Schweden und den Niederlanden hatten in Nordeuropa über acht Jahre hinweg 37.000 frei lebende Wasservögel untersucht und bei sechs Prozent der Tiere Influenza-Viren nachweisen können, jedoch keine einzige H5N1-Infektion.
Das erste große Massensterben unter Wildvögeln war ein H5N1-Ausbruch am nordchinesischen Qinghai-See (einem Rastplatz für Zugvögel), wo 2005 zahlreiche Streifengänse verendeten.
Eine Infektion mit A/H5N1 oder mit anderen Influenza-A-Viren kann besonders bei Hühnern und Puten, aber auch bei Fasanen, Wachteln und Perlhühnern zu schwerwiegenden Krankheitszuständen bis hin zum raschen Tod führen. Tauben sollen zwar selbst nicht sehr empfänglich für A/H5N1 sein, es wird aber befürchtet, dass sie die Erreger als mechanische Vektoren im Gefieder verbreiten. Wegen des möglichen, erheblichen wirtschaftlichen Schadens wurden auf der Grundlage nationaler Tierseuchengesetze durch diverse Verordnungen – in Deutschland zum Beispiel durch die Geflügelpest-Verordnung – Vorkehrungen für Schutzmaßnahmen nach dem Auftreten von Influenza-Infektionen getroffen.
Von welchen Wirtstieren A/H5N1 erstmals auf Zuchtgeflügel überging, ist bisher nicht bekannt. Es wird jedoch vermutet, dass die Viren bereits vor ihrem ersten Hervortreten unter Hühnervögeln (im Jahr 1997 in Hongkong) unter südchinesischen Enten und Gänsen verbreitet waren. Aufgrund der raschen Reaktion der Behörden von Hongkong, die 1997 den gesamten Zuchtgeflügelbestand töten ließen, habe man damals offenbar alle für Hühnervögel gefährlichen Virusvarianten ausrotten können.
Bei den erneuten Ausbrüchen des Erregers Ende 2003/Anfang 2004 in anderen Regionen Südostasiens wurde nicht mit ähnlich drakonischen Maßnahmen reagiert, so dass sich A/H5N1 von Jahr zu Jahr weiter ausbreiten konnte. Ein Vorgehen wie in Hongkong wäre angesichts der wirtschaftlichen Bedeutung, die der Geflügelzucht in anderen Regionen Südostasiens heute zukommt, kaum durchsetzbar gewesen. Thailand, Indonesien und Vietnam haben ihre Geflügelproduktion etwa von 1975 bis 2005 verachtfacht, die chinesische Produktion hat sich in den 1990er-Jahren verdreifacht. Das Hühnerfleisch stammt heute weit überwiegend aus Mastfabriken, die in der Nähe großer Städte liegen und Großunternehmen gehören; für Viren kann die Massentierhaltung gute Vermehrungsbedingungen bewirken. Auch rund um den Qinghai-See, wo 2005 erstmals ein Massensterben von Wildvögeln durch A/H5N1 nachgewiesen wurde, gibt es nach Angaben der Vogelschutzorganisation BirdLife zahlreiche Geflügelfarmen. Mit Unterstützung der FAO sei dort zudem eine Fischfarm errichtet worden, wobei der Hühnerkot aus den Geflügelfarmen als Fischfutter genutzt worden sei.
Im Sommer 2005 haben Robert G. Webster vom St. Jude Children’s Research Hospital in Memphis (USA) und seine Forscherkollegen aus Asien festgestellt, dass der Subtyp A/H5N1 die Hausenten in Asien inzwischen weniger stark erkranken lässt als noch vor Jahren. Damit bestehe die Gefahr, dass diese Hausenten als neue Reservoirwirte zu einem Sammelbecken für A/H5N1-Varianten werden und sie somit auch die Erreger auf andere Tierarten und den Menschen zunehmend übertragen können, denn sie scheiden die Viren ungewöhnlich lange über Kot und Atemwege aus. Tatsächlich wurden aus China ab 2006 einzelne H5N1-Infektionsfälle beim Menschen an die Weltgesundheitsorganisation (WHO) gemeldet, bei denen die Infektion offenbar durch Geflügel verursacht worden war, das dem äußeren Anschein nach „gesund“ war und das aus einem Gebiet stammte, in dem keine Wild- oder Zuchttiere an A/H5N1 verstorben waren.
Säugetiere sind weniger empfänglich für das Virus, wurden aber in den vergangenen Jahren ebenfalls gelegentlich infiziert. Bereits im Mai 2005 hatte beispielsweise die Fachzeitschrift Nature berichtet, dass offizielle Stellen in Indonesien A/H5N1 in Schweinen nachgewiesen hatten. Abstriche aus der Nase von 702 gesundheitlich nicht auffälligen indonesischen Schweinen, die zwischen 2005 und 2007 analysiert worden waren, erbrachten den Nachweis, dass 52 Tiere (7,4 %) mit H5N1-Viren infiziert waren. Zuvor hatte es bereits aus China Berichte über H5N1-Funde in Schweinen gegeben.
Der niederländische Forscher Albert Osterhaus wurde in der Zeit vom 19. Januar 2006 zitiert, dass A/H5N1 Hunde, Pferde, Pumas, Tiger und Leoparden infiziert habe, im Tierversuch auch Mäuse, Frettchen, Affen und Hauskatzen. Im März 2006 wurde zudem auf der Insel Rügen ein infizierter Steinmarder entdeckt.
Erstmals 2022 wurde auch bei einem Schweinswal A/H5N1 nachgewiesen, der am 28. Juni 2022 in Schweden (Kämpersvik, Gemeinde Tanum, Västra Götalands län) lebend gestrandet, jedoch bald verendet war.
Im März 2024 berichteten US-amerikanische Gesundheitsbehörden, dass in Texas und Kansas weltweit erstmals A/H5N1 bei Milchkühen nachgewiesen wurde und dass es einen Übergang des Virus auf einen Menschen gab. Die Kühe waren auffällig geworden durch Appetitlosigkeit und verminderte Milchbildung, H5N1-Viren wurden aus unpasteurisierter Milch und aus Abstrichen aus dem Mund-Rachen-Raum der Tiere isoliert. Der Patient litt an einer Bindehautentzündung und zeigte keine weiteren Symptome. Da auf dem Gelände der Milchkuh-Halter verendete Wildvögel gefunden wurden, ist nicht auszuschließen, dass A/H5N1 auf diesem Wege in die Tierhaltung eindrang. Nachfolgende Untersuchungen ergaben, dass auch in mehreren anderen US-Bundesstaaten H5N1-infizierte Milchkühe und auf dem Gelände von Milchkuh-Haltern infizierte Katzen nachgewiesen wurden. Ein zweiter Übergang von Kühen auf den Menschen wurde Ende Mai 2024 bekannt. Die Hausrinder überstehen die Infektion in der Regel, viele ohne sichtbare Zeichen einer Infektion. Katzen, die von der Rohmilch infizierter Kühe getrunken hatten, starben dagegen häufig.
Laut FLI besteht nach heutigem Stand der Wissenschaft kein Grund zur Besorgnis, dass Fische sich mit A/H5N1-Viren infizieren und dieses auf den Menschen übertragen können. Es sind bis heute keine Viren bei Vögeln und Säugern bekannt, die für Fische infektiös wären. Umgekehrt ist bisher auch keine Viruserkrankung bei Fischen nachgewiesen worden, die auf den Menschen oder auf Vögel übertragbar ist.
Die UN-Organisation für Landwirtschaft und Ernährung (FAO) hat Ende Mai 2006 Richtlinien herausgegeben, die zur Reduzierung der Ansteckungsgefahr mit A/H5N1 beitragen sollen. Die Empfehlungen befassen sich sowohl mit dem Ansteckungsrisiko von Tier zu Tier als auch von Tier zu Mensch, ferner werden Ratschläge zur Haltung von Geflügel sowie Tipps zur Verbesserung der Hygiene beim Umgang mit verendeten Tieren gegeben: Diese Tiere müssten verbrannt oder tief vergraben werden (s. auch Weblinks, FAO-Richtlinie). In den einzelnen betroffenen Ländern wurden häufig ähnliche, zum Teil aber auch sehr unterschiedliche Maßnahmen verordnet.
In der EU erfolgt die Bekämpfung von A/H5N1 aufgrund von EU-Recht sowie zusätzlich in allen europäischen Staaten auf der Grundlage nationaler Gesetze. In Deutschland ist dies vor allem das Tierseuchengesetz und die aus ihm abgeleitete Geflügelpest-Verordnung.
Wie alle anderen durch Influenzaviren verursachten Geflügelkrankheiten („Geflügelpest“) ist in Deutschland die Erkrankung mit A/H5N1 eine anzeigepflichtige Tierseuche (§ 1 Nr. 11 der Verordnung über anzeigepflichtige Tierseuchen), vergleichbare Regeln gibt es in Österreich und der Schweiz.
Die EU-weiten und nationalen Regelungen schreiben derzeit vor, dass bei Ausbrüchen von Influenza-Erkrankungen in der Tierhaltung der gesamte Tierbestand der betroffenen Halter zu töten ist („Keulung“). Die Kadaver werden verbrannt oder auf andere Weise unschädlich gemacht, um eine Übertragung auf andere Tierbestände zu verhindern. Daher ist die Anzahl der getöteten Tiere regelmäßig sehr viel größer als die Zahl der nachweislich infizierten Tiere. Dies wiederum hat zur Folge, dass keine verlässlichen Daten über die Anzahl erkrankter Tiere und auch nur grobe Schätzungen zur Zahl der vorbeugend getöteten Tiere existieren. Ferner werden Schutzzonen um den Fundort infizierter Tiere eingerichtet, in denen der Transport von Vögeln und Geflügelprodukten teils untersagt, teils genehmigungspflichtig ist. Die ursprünglich für Influenza-Erkrankungen in der Tierhaltung gedachten Schutzzonen können auch auf Einzelfunde infizierter Wildvögel angewandt.
Noch in den Anfängen steht die Überwachung des internationalen Handels mit industriellem Geflügelfutter, das auch Hühnerfleisch und Hühnerabfall und damit Reste von Kot, Federn oder Einstreu enthält.
Um einheimisches Geflügel vor einer möglichen Übertragung von Influenzaviren durch Wildvögel zu schützen, wird seit 2005 in Europa auch ein erweitertes Überwachungsprogramm (Wildvogelmonitoring) durchgeführt, vorrangig bei wild lebenden Enten und Gänsen. Das Beprobungsprogramm stützt sich u. a. auf Sentinel-Anlagen („Wächtertieranlagen“), in denen flugunfähige Stockenten gehalten und frei lebende Wildvögel durch regelmäßige Futtergaben angelockt werden, auf Beringungsstationen, Naturschutzbehörden und Jäger. Proben wie Rachen- und Kloakentupfer, Blut oder Kot werden an die zuständige Untersuchungseinrichtung geschickt und dort auf Influenzaviren getestet.
Nachdem sie über acht Jahre hinweg in Schweden und den Niederlanden knapp 37.000 frei lebende Enten, Gänse und andere Wasservögel auf Influenzaviren untersucht hatten, berichtete eine Expertengruppe im Frühjahr 2007, dass im Mittel bei sechs Prozent der Tiere Influenzaviren nachweisbar waren, jedoch keine H5N1-Viren. Die Infektionsraten unterlagen erheblichen jahreszeitlichen Schwankungen: Während im Frühjahr nur selten Influenzaviren gefunden wurden, erwiesen sich im Herbst über 20 Prozent der Enten als influenzainfiziert.
Für Tiere gibt es seit langem eine Reihe wirksamer Totimpfstoffe gegen Influenzaviren, ferner wurden – u. a. in China – seit 2005 mehrere Lebendimpfstoffe zur Marktreife entwickelt. In Deutschland ist die Impfung gegen die Geflügelpest allerdings nur in Ausnahmefällen erlaubt. Für Hühner gibt es auch einen zugelassenen DNA-Impfstoff.
Auch die Weltgesundheitsorganisation warnte wiederholt nachdrücklich vor Impfungen, da geimpfte Tiere nicht mehr von virentragenden Tieren unterschieden werden könnten. Überdies könnten geimpfte, infizierte Vögel zu Überträgern der Viren werden, ohne selbst Symptome zu zeigen. Auch bestehe die Gefahr, dass die Viren in unerkannt infizierten Tieren mutieren und dass diese Erbgutveränderungen sich leichter ausbreiten könnten als in nicht-geimpften Beständen, da diese ja nach jedem Ausbruch getötet würden; eine derartige Entwicklung wurde nach einem H5N2-Ausbruch in Mexiko beobachtet. Dennoch gab es am 20. Oktober 2005 seitens der EU die Forderung an die Mitgliedsländer, Impfprogramme für Zootiere vorzubereiten. Besonders bei seltenen Arten dürfen die einzelnen deutschen Bundesländer seitdem das Impfen von Zootieren zulassen.
Am 15. November 2005 wurde der Generaldirektor der Weltorganisation für Tiergesundheit (Weltorganisation für Tiergesundheit, OIE) in Pressemeldungen zitiert, dass A/H5N1 in Vietnam und Indonesien nicht mehr eingedämmt werden könne, indem man dort nur Tiere schlachte. Er sprach sich daher für eine flächendeckende Impfung der Tiere aus. Am gleichen Tag kündigte die Volksrepublik China eine Impfung ihres gesamten Geflügelbestandes an, der nach offiziellen Schätzungen 15 Milliarden Tiere umfassen soll. Seit den H5N1-Ausbrüchen in Nigeria werden auch in dieser Region in großem Umfang Impfungen durch UN-Organisationen vorgenommen, da die Seuche durch andere Maßnahmen nicht mehr einzudämmen sei.
Die Befürworter von Impfungen verweisen darauf, dass es mit Hilfe eines Antikörpertests routinemäßig möglich sei, Influenza-Infektionen auch bei geimpften Tieren nachzuweisen. Der Impfstoff rege die Tiere zur Herstellung von Antikörpern an, die sich geringfügig – aber nachweisbar – von jenen Antikörpern unterscheiden, die der so genannte Wildtyp hervorruft. Ein solcher Impfstoff sei in Norditalien bei Verona bereits mehr als ein Jahr lang erfolgreich im Kampf gegen H5- und H7-Ausbrüche eingesetzt worden. Geimpfte Truthühner, so die Erfahrungen in Italien, seien zudem wesentlich schwieriger mit Influenzaviren zu infizieren und schieden im Falle einer Infektion wesentlich weniger Viren aus.
29.10.2025, Bundesverband für Tiergesundheit e.V.
Die Vogelgrippe-Saison startet: Möglichkeiten der Impfung nutzen!
Der BfT ruft dazu auf, die Seuchenbekämpfungsstrategie zu überdenken und die Türen für eine Impfung gegen die Vogelgrippe zu öffnen.
Der Bundesverband für Tiergesundheit e.V. (BfT) fordert bereits seit einiger Zeit, Impfungen vermehrt in die Seuchenbekämpfung einzubeziehen und der präventiven Impfung einen höheren Stellenwert einzuräumen. Die massiven Ausbrüche der Vogelgrippe bereits zu Beginn der Wintersaison zeigen einmal mehr, dass angesichts der breiten Verbreitung des Virus in der Wildvogelpopulation ein Umdenken erforderlich ist.
In Frankreich bestehen bereits seit einiger Zeit gute Erfahrungen mit der Impfung von Enten, die Niederlande haben in einem Pilotversuch Impfungen bei Legehennen getestet. Italien hat die Impfung im Rahmen von Feldversuchen bei Puten eingesetzt. Im Gegensatz zu anderen Erkrankungen wie der Afrikanischen Schweinepest liegen für Impfungen gegen die Vogelgrippe entsprechende Konzepte und praxisreife Impfstoffe vor. Positive Signale aus Handel und Politik sind erforderlich, um die Entwicklung und Zulassung der Impfstoffe weiter voranzutreiben. Verbindliche Entscheidungen über die Genehmigung einer Impfung und benötigte Mengen sind Voraussetzung, um ausreichend Impfstoffe bereitstellen zu können.
Die Anforderungen für das Monitoring auf Einträge des Feldvirus laut EU-Recht müssen weiterentwickelt und auf ein praktikables Maß reduziert werden. Auch hier schaffen neue Testverfahren neue Optionen. Handelsbarrieren müssen überwunden werden.
Auch wenn insbesondere in geschlossenen Haltungssystemen durch hohe Biosicherheitsmaßnahmen Einschleppungen weitgehend verhindert werden können, zeichnet sich ab, dass dies keinen ausreichenden Schutz für alle Betriebe darstellt.
„Besonders gefährdet sind Freilandhaltungen und Wassergeflügel“, so Dr. Sabine Schüller, Geschäftsführerin des BfT, „vor allem in Regionen mit starkem Vogelzug. Auch Putenbetriebe haben ein erhöhtes Infektionsrisiko. Den Betrieben sollte die Impfung als ergänzende Option zu Biosicherheitsmaßnahmen ermöglicht werden.“
„Durch den Einsatz der Impfung kann vielfaches Tierleid verhindert, erhebliche Kosten für Tötung und Beseitigung eingespart und die Versorgung mit Eiern und Geflügelfleisch gesichert werden“, so Schüller. Nicht zuletzt sei die vorbeugende Impfung statt der Tötung von Tieren auch ein Beitrag zur Nachhaltigkeit.
28.10.2025, Wildtierschutz Deutschland e.V.
Vogelgrippe: Wildvögel sind nur die Opfer – Täter ist die Geflügelwirtschaft
Den ersten großen Ausbruch der Vogelgrippe unter Wildvögel in Mitteleuropa gab es mit etwa 20.000 toten Nonnengänsen im Winter 2021/22. Als die Situation sich erwartungsgemäß im Frühjahr hätte beruhigen sollen, ging die HPAI (= Hochpathogene Aviäre Influenza = hochansteckende Vogelgrippe / Geflügelpest) zur Brutzeit erst richtig los. Neben Gänsevögeln einschließlich Schwänen und Enten war beinahe jede koloniebrütende Vogelart betroffen, darunter Graureiher, Kormorane, Löffler und insbesondere Möwen und Seeschwalben. Neben der Flussseeschwalbe traf es die Brandseeschwalbe knallhart.
Zahlreiche Möwenkolonien, besonders Lachmöwenkolonien, waren statt lärmerfüllt mit Leichen gepflastert. In der einzigen Basstölpelkolonie Deutschlands auf Helgoland starben während der Brutsaison 2022 50 % der Altvögel und 90 % der Jungvögel.
Die Vogelgrippe weitet sich auf andere Tierarten aus
2023 waren vermehrt auch Greifvögel betroffen – womöglich nachdem sie infizierte Vögel gefressen haben – außerdem wurden Eulen, Störche, Sturmvögel, Blässrallen und Regenpfeifer(artige), darunter Waldschnepfen und Austernfischer, und ab Herbst 2023 auch Kraniche positiv getestet. Singvögel gelten bisher noch als ungefährdet. Doch vielleicht werden wir bald eines Besseren belehrt, nachdem auch zahlreiche Krähenvögel – die zu den Singvögel gehören – verendet sind. Inzwischen ist Vogelgrippe ein ganzjähriges Problem, aber verschwand aus den Medien. Fallzahlen können beim Tierseucheninformationssystem (TSIS) eingesehen werden.
Längst ist Vogelgrippe keine Vogelkrankheit mehr: Füchse, Marder, Bären und Robben sind weltweit bereits an Vogelgrippe gestorben; sogar Tiger in einem Zoo nach dem Genuss infizierter Vögel.
Immer wieder bekommen wir zu hören, dass Vogelgrippe bei Wasservögeln, speziell Gänsen und Enten, weit verbreitet ist und über diese global verbreitet wird. Darin befindet sich aber nur wenig Wahrheit. Denn man muss – auch wenn das kaum jemand macht – zwischen Hochpathogener aviärer Influenza (HPAI) und Niedrigpathogener (NPAI) unterscheiden. Letztere hat eine Verbreitung in der Vogelwelt; ist aber nur äußerst selten gefährlich für Vögel und nie für Menschen. Die hochansteckende Variante (HPAI) dagegen ist auf die Geflügelzucht zurückzuführen.
Ursprung der hochansteckenden Variante der Vogelgrippe: Asien
In den letzten 20 Jahren mutierten NPAI-Viren vor allem in Südostasien zu den HPAI-Varianten, die jetzt die bekannten weltweiten Probleme verursachen. Einer der Gründe für die Ausbreitung vor Ort waren Impfungen von Geflügelbeständen. Gegen Vogelgrippe geimpftes Geflügel wird selbst nicht krank, produziert aber (in geringem Maße) Viren und scheidet diese aus. Unter diesen Bedingungen konnten in geimpften Vögeln mehrere Vogelgrippeviren aufeinandertreffen und zu einem „Supervirus“ mutieren. Durch den innerasiatischen Handel mit geimpften Vögeln wurden auch die Superviren immer weiterverbreitet. In Europa sind Impfungen gegen Vogelgrippe aus diesem Grund bisher verboten.
Doch auch ohne Impfungen können sich in engen Massentierhaltungen verschiedene Vogelgrippeviren begegnen und vermischen, wenn Vögel aus verschiedenen Haltungen zusammengeführt werden. Besonders wenn Entenbestände betroffen sind, werden Vogelgrippeerreger leicht in andere Haltungen verbreitet, da bei Enten die Krankheitssymptome erst nach mehreren Wochen ausbrechen.
Auf jeden Fall muss man festhalten, dass an der Entstehung der Hochpathogenen Vogelgrippe (HPAI) Prozesse beteiligt waren, die unter natürlichen Bedingungen nicht vorkommen. Würde ein solcher Virus im Freiland entstehen, würde er die betroffenen Vögel so schnell töten, dass eine Weiterverbreitung nicht möglich ist.
Versagen des Friedrich-Löffler-Instituts
Doch nach der Haupttheorie des Friedrich-Löffler-Instituts (FLI) hat genau das stattgefunden; angeblich erfolgte der Haupteintrag der Viren von Südostasien nach Europa über Zugvögel. Es braucht schon einen gewaltigen Spagat, um einen solchen Zugweg zu konstruieren und dann auch entsprechend mit der lebensbedrohlichen Variante infizierte Vögel, die gesund genug sind, diesen zu überstehen. Nachdem das unabhängige Wissenschaftsforum Aviäre Influenza wiederholt nachweisen konnte, daß neue Virusvarianten der HPAI stets wenige Wochen nach der Entdeckung in Südostasien auch in Europa ankamen (viel schneller als jeder Zugvogel selbst bei hypothetischem Direktflug), musste das FLI eine „Rolle“ des Geflügelhandels einräumen.
Und doch hat das FLI in den letzten 20 Jahren Geld und Energie darauf verschwendet, Beweise für die Wildvogelthese zu finden, anstatt effektive Strategien zu entwickeln, wie Wildvögel oder auch die Geflügelindustrie effektiv vor HPAI geschützt werden können. Stattdessen wurden Freiland-Geflügelhalter mit immer wieder angeordneten Stallpflichten in den Konkurs gemobbt. Private Geflügelzüchter taten bei verordneter Stallpflicht genau das, was man nicht tun sollte: sie reicherten unsere Natur mit Exoten an.
Ineffizientes Monitoring durch Abschuss von gesunden Wasservögeln
Hunderttausende Enten und Gänse mussten und müssen ihr Leben lassen bei dem Versuch, HPAI in freilebenden, gesund wirkenden Wasservögeln nachzuweisen. Ein überzeugender Beweis wurde jahrelang nicht gefunden. Zum einen lässt dieses „Monitoring per Abschuss“ keine Aussage über den Gesundheitszustand der Wildvögel zu, zum anderen konnte nur eine Handvoll Einzelnachweise jeweils in unmittelbarer Umgebung zu Ausbrüchen in der Geflügelindustrie erbracht werden.
Dabei ist der Beweis, dass Wildvögel die Opfer der industriell generierten HPAI sind und nicht die Täter, bereits schmerzlich erbracht. Wäre HPAI natürlich entstanden oder verbreitet worden, dann hätten wir die Ausbruchs- und Sterbewellen, die wir seit 2021 unter Wildvögeln erleben, viel früher gehabt, nämlich lange bevor es Fälle in Geflügelmastanlagen gab. Aus den Daten von TSIS geht hervor, dass die Hochpathogene Vogelgrippe in Deutschland frühestens 2020 in Wildvogelbeständen etabliert wurde.
Dabei erhielten wir bereits 2007 eine deutliche Warnung, wie sich HPAI auswirken kann, wenn sie ins Freiland gelangt. Damals starben 246 von rund 450 Schwarzhalstauchern, die zur Mauser den Helme-Stausee an der Grenze von Thüringen und Sachsen-Anhalt aufgesucht hatten. Man hat es versäumt, der Ursache auf den Grund zu gehen. Der Eintrag der Vogelgrippe könnte z. B. über ausgesetzte Fische erfolgt sein, die zuvor mit Futtermitteln aus Geflügelabfällen gefüttert wurden.
Der Umstand, dass es absolut üblich ist, Einstreu inklusive Kadaver aus Geflügelställen (wie auch aus anderen Mastanlagen) als „Dünger“ auf Äckern zu entsorgen, könnte eine Erklärung sein, warum bei Gänsen – die gern auf Äckern nach Nahrung suchen – besonders häufig Vogelgrippeviren nachweisbar sind.
Interessanterweise hat eine niederländische Forschungsgruppe festgestellt, dass arktische Gänse und Enten, die Mitteleuropa zur Überwinterung aufsuchen, selbst auf Niedrigpathogene Vogelgrippeviren empfindlich reagieren. Das legt den Verdacht nahe, dass selbst Niedrigpathogene Vogelgrippe (NPAI) unter natürlichen Bedingungen keineswegs so verbreitet ist, wie wir heute annehmen, sonst müssten auch diese Arten Erfahrungen damit haben und immun sein.
Das oben erwähnte Abschuss-Monitoring hat gezeigt, dass NPAI seine weitaus häufigste Verbreitung in Stockentenbeständen hat. Dazu muss man wissen, dass es in vielen Ländern – und beinahe allen unseren Nachbarländern – üblich ist, Stockenten in großem Stil zu züchten und dann zur Anreicherung der Jagdstrecke in die freie Wildbahn auszusetzen. Vor diesem Hintergrund ist jedenfalls zu hinterfragen, ob selbst die eingangs erwähnte weite Verbreitung der NPAI in Wildvogelbeständen ein natürlicher Zustand ist oder durch die Geflügelzucht herbeigeführt wurde.
In München war bei der Ausbruchswelle 2023 auffällig, dass infizierte Wasservögel vor allem an Stellen gefunden wurden, wo direkt am Gewässerufer gegrillt wird.